共同研究体制と実験支援環境が充実。
先駆的かつ独創的な研究成果を生み出す。
滋賀医大の研究環境における最大の利点は、臨床、基礎、研究センターの間の垣根が低く、各々の領域で世界のトップランナーの研究者のもと、共同研究体制が築きやすいことが挙げられます。また、実験支援センター、動物生命科学研究センターなどの実験支援環境が充実し、最新機器を用いた研究が行なえます。
滋賀医大神経内科は以前、糖尿病内科を中心とする第三内科に属しており、糖尿病性ニューロパチーや神経障害性疼痛の病態解明や新規治療法開発について、先駆的かつ独創的な研究成果を上げてきました。
2016年7月に漆谷が滋賀医大神経内科学講座教授に着任した後は、専門分野である筋萎縮性側索硬化症(ALS)、そしてアルツハイマー病をはじめとする神経変性疾患の病態解明と治療法の開発を目指した基礎研究チーム、さらに神経病理学研究、バイオマーカー探索やメタ解析を通じた薬物・非薬物介入法開発や難病ケアの質向上を目的とする臨床研究チームが発足しました。さらに急性虚血や慢性低灌流による脳機能障害の病態解明と新規治療の開発研究、滋賀県脳卒中データベースを用いた疫学研究を進める脳卒中チーム、中枢、末梢の電気生理学や神経リハビリテーションの機能画像評価などの神経生理学チームが研究活動を展開しています。
内科学講座脳神経内科は神経難病研究センター臨床研究ユニット、ミスフォールド蛋白質関連疾患治療学講座(共同研究講座)と2つの関連講座を有し、上記基礎・臨床研究開発を有機的に進めています。
これらの研究は大学内・病院内の他講座、学外施設(京都大学、自治医科大学、東邦大学、名古屋市立大学、徳島大学、愛知医科大学、福岡大学など)との共同研究によって支えられています。
学内共同研究
- ■脳神経外科学講座 脳卒中の疫学研究
- ■動物生命科学研究センター ALSモデルサルの作出プロジェクト
- ■リハビリテーション部 神経難病リハビリテーションと電気生理、MRI機能画像研究
- ■栄養治療部 ALSによけるエネルギー代謝異常と栄養治療についての共同研究
- ■看護学科 ALS患者在宅診療における呼吸機能のモニター方法についての共同研究
学外施設との共同研究
- ■京都大学(再生ウイルス研究所) ALS治療抗体のボルナウイルスベクター開発研究
- ■自治医科大学 ALS治療抗体のアデノ関連ウイルスベクター(AAV)開発研究
- ■徳島大学 医師主導治験(高容量メチルコバラミン)、遺伝子解析研究
- ■愛知医科大学 ミスフォールドSOD1認識抗体を用いた神経病理学的研究
- ■福岡大学 特異抗体を用いたTDP-43の病原構造解析
- ■東邦大学 ALSの痙縮に関する評価指針の作成研究
ALSの原因蛋白質による病態の解明と新規分子標的治療法の開発研究
team:漆谷、玉木、引網、矢端
ALSを取り巻く研究上の進展は著しく、毎年教科書に加わるような発見が続いています。現在ALSは多くの因子を原因とする多因子疾患であり、その究極に異常蛋白質病とRNA病としての2大側面を有すると、理解されています。我々は以前より前者に着目し家族性・孤発性ALSの原因蛋白質による運動ニューロン変性の機序を研究してきました。これまでに家族性ALSの原因と一つである変異SOD1蛋白質がシナプス分泌蛋白質とともに細胞外に分泌されミクログリアの活性化や運動ニューロン死をきたすことを突き止め、ワクチン・抗体療法の有用性を報告しました。現在、新たなALSモデルの作製と細胞内抗体や低分子スクリーニングによる新規の治療・診断法を細胞移植や遺伝子治療と組み合わせて進めており、2018年には孤発性ALSの治療標的であるTDP-43の異常凝集体を特異的に除去する自己分解型細胞内抗体の開発に成功しました(プレスリリース、AMED採択、命の彩受賞、上原記念生命リサーチフェローシップ)。現在、細胞質にTDP-43が異所性局在するALSのモデルマウスを用いて用いて、有効性と安全性を検証する前臨床研究を進めています。一方家族性ALSで最も頻度の高い変異蛋白質であるSOD1に対して、独自の一本鎖モノクローナル抗体の分泌能を付与したオリゴデンドロサイト前駆細胞(OPC)の移植治療を行い、モデル動物において有望な結果が得られています(第59回日本神経学会最優秀ポスター賞、宇宙兄弟セリカ基金受賞)。さらに家族性ALSにおいて2番目に頻度が高く、若年性ALSの代表的遺伝子であるFUS変異において病態の鍵を握るFUS結合タンパク質を同定しており、病態解析を進めています(科研費スタートアップ支援採択)。
研究成果のご紹介
自己分解型細胞内抗体を用いたALSの異常凝集体の除去治療の開発
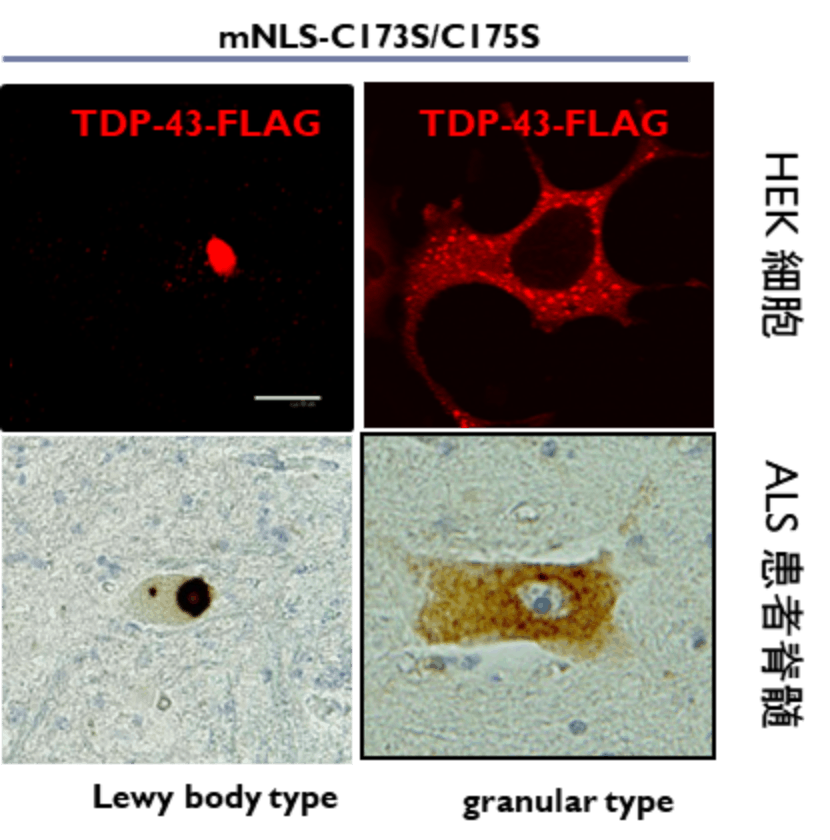
ALSの9割を占める孤発性症例の病巣にはユビキチン陽性の異常封入体が存在することが知られていましたが、その本体がTDP-43という、本体核内でRNA代謝に重要な役割を果たす蛋白質であることが判明しました。さらにTDP-43の異常凝集体はRNA代謝障害やストレス顆粒の形成不全、蛋白分解障害など様々な有害カスケードを引き起こすなど、ALS病態に本質的な役割を果たすことが明らかとなり、TDP-43の異常凝集体の除去はALSの根治療法に直結する可能性があります。ところが、TDP-43は細胞生存にとって極めて重要な蛋白質であり、異常構造のみを除去することが重要です。
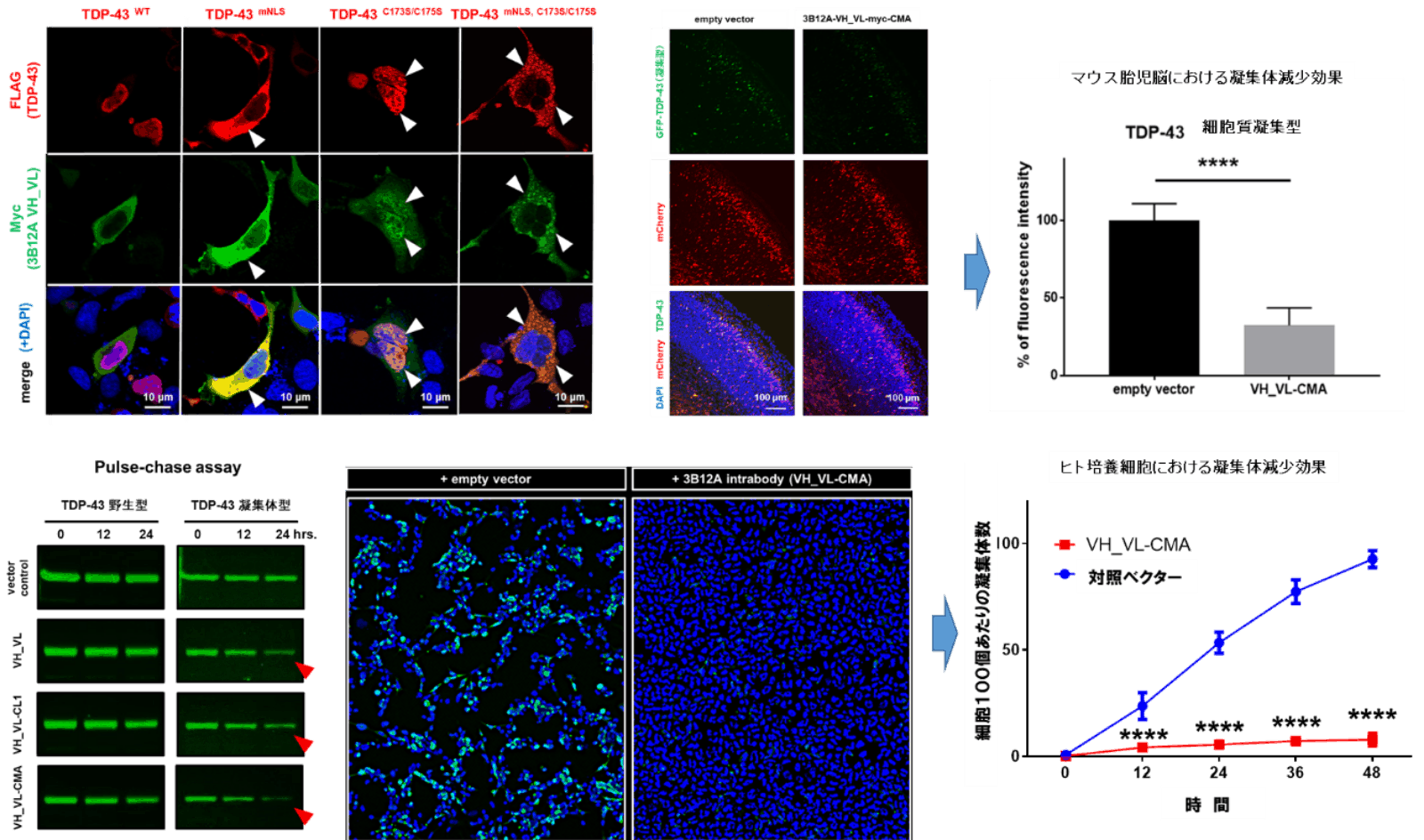
部位である可変領域(VH, VL)をコードする部分をクローニングし、一本鎖抗体を構築してベクターに組み込ませることによって細胞内で抗体を作らせるシステムを確立しました。さらにこの抗体にオートファジーでの分解を促進するシグナル(CMA)を付加することで、異常蛋白質と結合した後、自らと共に速やかに分解される「自己分解型細胞内抗体」を開発し、培養細胞や胎仔マウス脳におけるTDP-43の異常凝集体を除去することに成功しました。

関連業績
- Wada H, Hikiami R, Kusui M, Minamiyama S, Asada-Utsugi M, Shodai A, Muramatsu SI, Morimura T, Urushitani M. In vivo analysis of aggregation propensity of low levels of mislocalized TDP-43 on cytopathological and behavioral phenotype of ALS/FTLD. Neurosci Res. 2023 Feb 16:S0168-0102(23)00040-8. doi: 10.1016/j.neures.2023.02.006.
- Minamiyama S, Sakai M, Yamaguchi Y, Kusui M, Wada H, Hikiami R, Tamaki Y, Asada-Utsugi M, Shodai A, Makino A, Fujiwara N, Ayaki T, Maki T, Warita H, Aoki M, Tomonaga K, Takahashi R, Urushitani M. Efficacy of oligodendrocyte precursor cells as delivery vehicles for single-chain variable fragment to misfolded SOD1 in ALS rat model. Mol Ther Methods Clin Dev. 2023 Feb 4;28:312-329. doi: 10.1016/j.omtm.2023.01.008.
- Tamaki Y, Ross JP, Alipour P, Catoire H, Rochefort D, Urushitani M, Takahashi R, Sonnen JA, Stifani S, Dion PA, Rouleau G. Spinal cord extracts of amyotrophic lateral sclerosis spread TDP-43 pathology in cerebral organoids. PLoS Genetics, 2023, in press
- Hikiami R, Morimura T, Ayaki T, Tsukiyama T, Morimura N, Kusui M, Wada H, Minamiyama S, Shodai A, Asada-Utsugi M, Muramatsu S, Ueki T, Takahashi R, Urushitani M. Conformational change of RNA-helicase DHX30 by ALS/FTD-linked FUS induced mitochondrial dysfunction and cytosolic aggregates. Sci Rep 12, 16030 (2022). https://doi.org/10.1038/s41598-022-20405-2
- Tamaki Y, Shodai A, Morimura T, Hikiami R, Minamiyama S, Ayaki T, Tooyama I, Furukawa Y, Takahashi R, Urushitani M. Elimination of TDP-43 inclusions linked to amyotrophic lateral sclerosis by a misfolding-specific intrabody with dual proteolytic signals. Sci Rep, 2018, 8, 6030
- Shodai A, Morimura T, Ido A, Uchida T, Ayaki T, Takahashi R, Kitazawa S, Suzuki S, Shirouzu M, Kigawa T, Muto Y, Yokoyama S, Takahashi R, Kitahara R, Ito H, Fujiwara N, Urushitani M. Aberrant assembly of RNA-recognition motif 1 links to pathogenic conversion of TAR DNA-binding protein-43 (TDP-43). J Biol Chem 2013, 288, 21, 14886-14905.
- Shodai A,, Ido A, Fujiwara N, Ayaki T, Morimura T, Oono M, Uchida T, Takahashi R, Ito H, Urushitani M. Conserved Acidic Amino Acid Residues in a Second RNA Recognition Motif Regulate Assembly and Function of TDP-43. PLoS ONE 2012, 7, e52776
- Takeuchi S, Fujiwara N, Ido A, Ono M, Takeuchi Y, Tateno M, Suzuki K, Takahashi R, Tooyama I, Taniguchi N, Julien JP, Urushitani M. Induction of protective immunity by vaccination with wild-type apo SOD1 in the mutant SOD1 transgenic mice. J Neuropathol Exp Neurol 2010, 69, 1044-1056
- Urushitani M, Ezzi SA, Julien JP. Therapeutic effects of immunization with mutant superoxide dismutase in mice models of ALS. Proc Natl Acad Sci U S A 2007, 104, 2495-2500
- Urushitani M, Sik A, Sakurai T, Nukina N, Takahashi R, Julien JP. Chromogranin-mediated secretion of mutant superoxide dismutase proteins linked to amyotrophic lateral sclerosis. Nat Neurosci 2006, 1:108-118
タウオパチーにおける二本鎖DNA損傷修復の破綻とNFT形成メカニズムの解明
team:浅田、漆谷
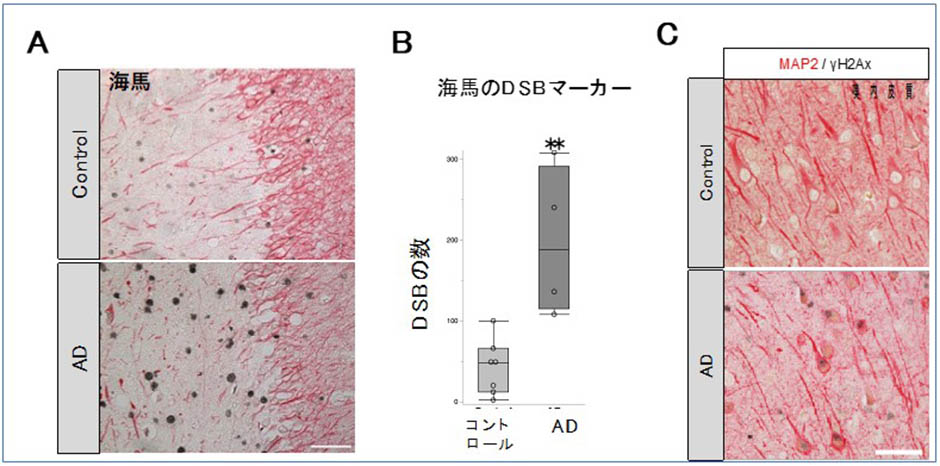
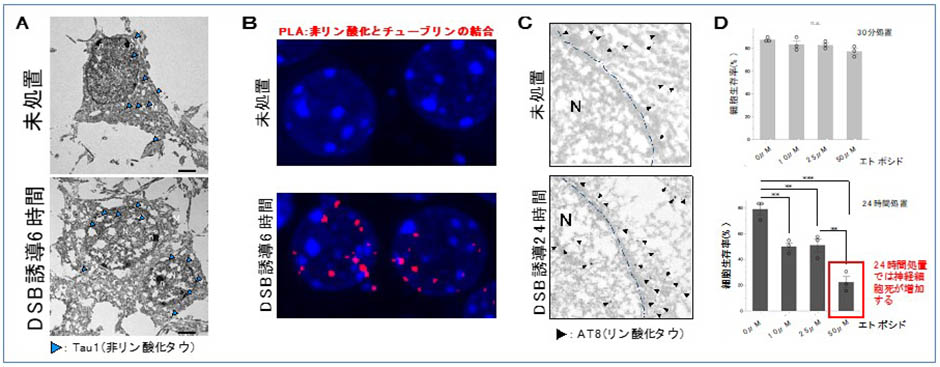
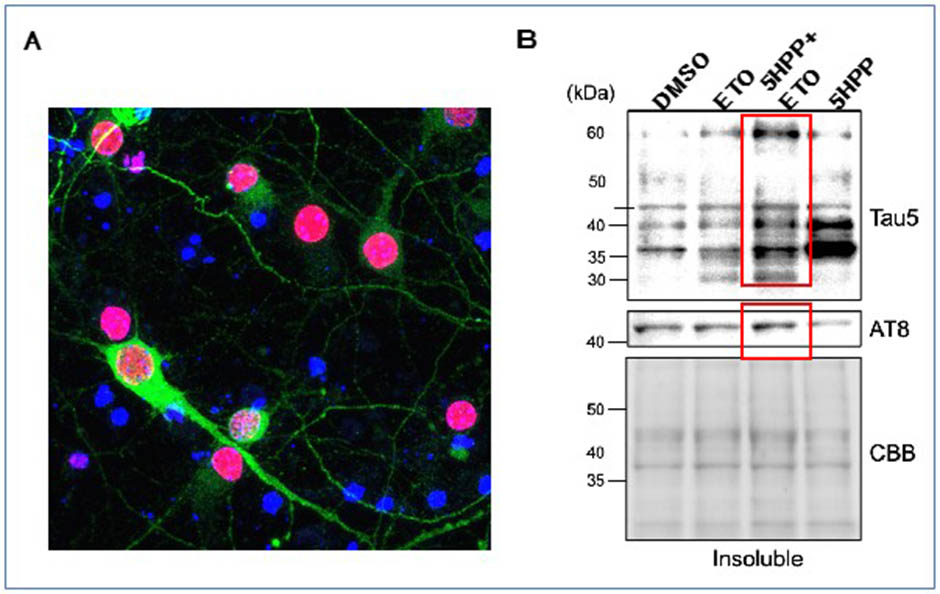
アルツハイマー型認知症をはじめ、タウの蓄積(神経原線維変化: Neurofibrillary tangles: NFT)を病理学的特徴とするタウオパチーに対する薬物治療は臨床症状を緩和する症状改善薬が中心であり、根治可能な薬物療法は存在しませんでした。しかし近年、アルツハイマー型認知症に対する新しい分子標的治療の開発が進んでいます。そこで、発症までの分子機構の詳細が解明されれば、認知症の発症予防および治療ができる革新的な創薬開発に繋がると考えられます。私達は神経細胞における二本鎖DNA損傷(Double strand break: DSB)修復と微小管結合タンパク質であるタウの関連性に着目し、タウの新たな生理機能として早期のDSB修復に関与すること、また微⼩管脱重合とDSBの蓄積はタウ病理を促進することを世界で初めて報告しました(M. Asada-Utsugi et al. Featured Article in Commun. Biol.2022)。本研究は、タウオパチーとDNA修復応答分野という、当該分野ではこれまで全く想定されていなかった新しい研究分野を創出し、NFTを介した神経細胞死の考え方にDNA損傷応答という新たなアイディアを与えるものです。そしてこれらの知見は、これまでのアルツハイマー型認知症創薬とは異なる治療薬の開発に繋がることと考えています。
関連業績
- Asada-Utsugi M, Uemura K, Ayaki T, Uemura T-M, Minamiyama S, Hikiami R, Morimura T, Shodai A, Takahashi R, Ueki T, Kinoshita A, Urushitani M. Failure of DNA Double-Strand Break Repair by Tau Mediates Alzheimer’s disease Pathology in vitro. Commun Biol 2022, Vol. 5, 358, DOI: 10.1038/s42003-022-03312-0
- Asada-Utsugi M, Uemura K, Kubota M, Noda Y, Tashiro Y, Uemura M, Yamakado H, Urushitani M, Takahashi R, Hattori S, Miyakawa T, Ageta-Ishihara N, Kobayashi K, Kinoshita M, Kinoshita A. Mice with a cleavage-resistant N-cadherin exhibit synapse anomaly in the hippocampus and outperformance in spatial learning tasks. Mol Brain 2021, in press. DOI: https://doi.org/10.21203/rs.3.rs-64344/v2
神経難病に対する神経リハビリテーション治療の開発と脳コネクトーム解析
team:山川
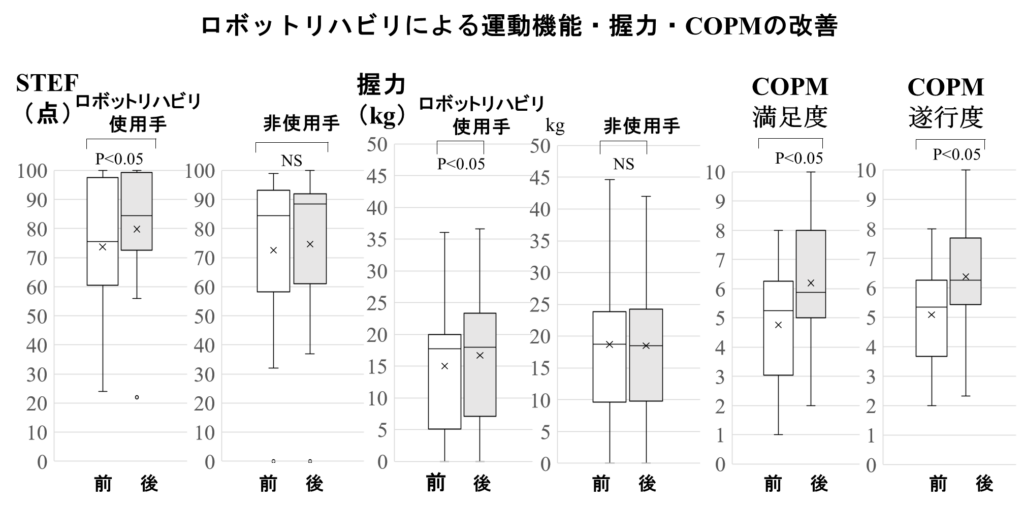
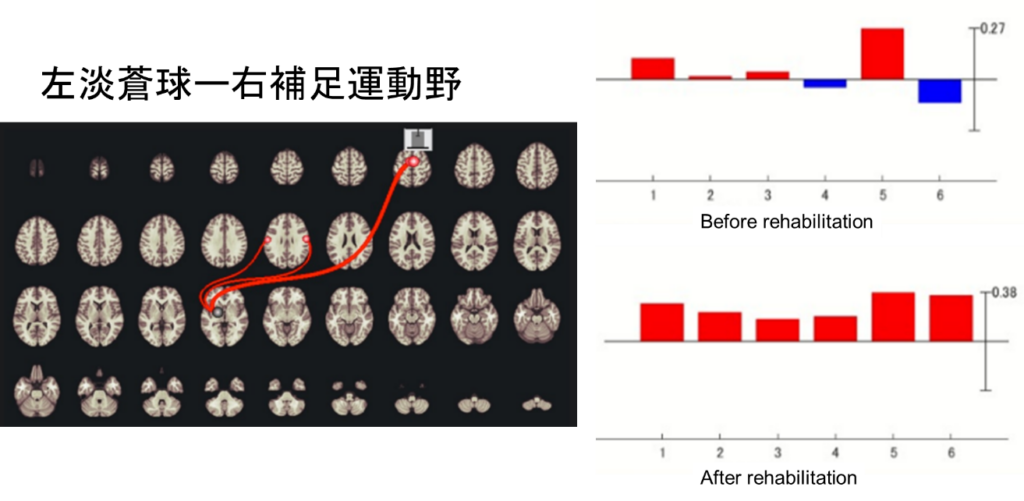
神経難病の多くを占める神経変性疾患。薬剤の効果は限定的ですが、リハビリテーションの有効性が注目されています。従来は筋力低下のため日常運動の機会が減ることによって生じる廃用性萎縮の予防や、関節可動域の維持が主目的で、積極的な効果を目指すものではありませんでした。特にALSにおいては、過度なリハビリテーションが病気の進行を悪化させるという報告が増え、他の麻痺性疾患同様の筋力増強トレーニングは出来ません。近年HALと呼ばれる下半身装着型のロボットスーツがALSに保険適用され、有効性の報告があります。一方手指の巧緻性障害に対するリハビリテーションについては有効な手段の報告はありませんでした。我々は手指先端にセンサーの設置され、手指の把握を屈曲によってサポートするSEMグローブを用いたリハビリテーションがALSで有効であること、そしてその効果には脳内部位間連結(コネクティビティ)の形成が寄与していることを報告しました。脊髄小脳変性症における集中リハビリテーションの効果における脳内コネクティビティとの関連についても研究を進めています。
関連業績
- Yamakawa I, Yamada A, Sonoda Y, Wakita K, Nishioka T, Harada Y, Ogawa N, Kitamura A, Sanada M, Tani T, Imai S, Urushitani M. Occupational therapy using a robotic-assisted glove ameliorates finger dexterity and modulates functional connectivity in amyotrophic lateral sclerosis. J Clin Neurosci. 2022 Nov 18:S0967-5868(22)00446-5. doi: 10.1016/j.jocn.2022.11.004. Epub ahead of print. PMID: 36411175.
- Sonoda Y, Yamanaka Y, Sawano S, Komada R, Kugo M, Kitamura A, Ogawa N, Yamakawa I, Kim H, Sanada M, Imai S, Urushitani M. Amelioration of motor and non-motor symptoms in cortical cerebellar atrophy and multiple system atrophy-cerebellar type by inpatient rehabilitation: a retrospective study. Int J Rehabil Res, 2021. DOI: 10.1097/MRR.0000000000000455
- Sonoda Y, Yoshida N, Kawami K, Kitamura A, Ogawa N, Yamakawa I, Kim H, Sanada M, Urushitani M. Short-term effect of intensive speech therapy on dysarthria in patients with sporadic spinocerebellar degeneration. J Speech Lang Hear Res. 2021 Mar 17;64(3):725-733.
急性期脳梗塞、脳慢性低灌流における病態修飾分子の同定と 新規治療法の開発研究
team:北村、小川
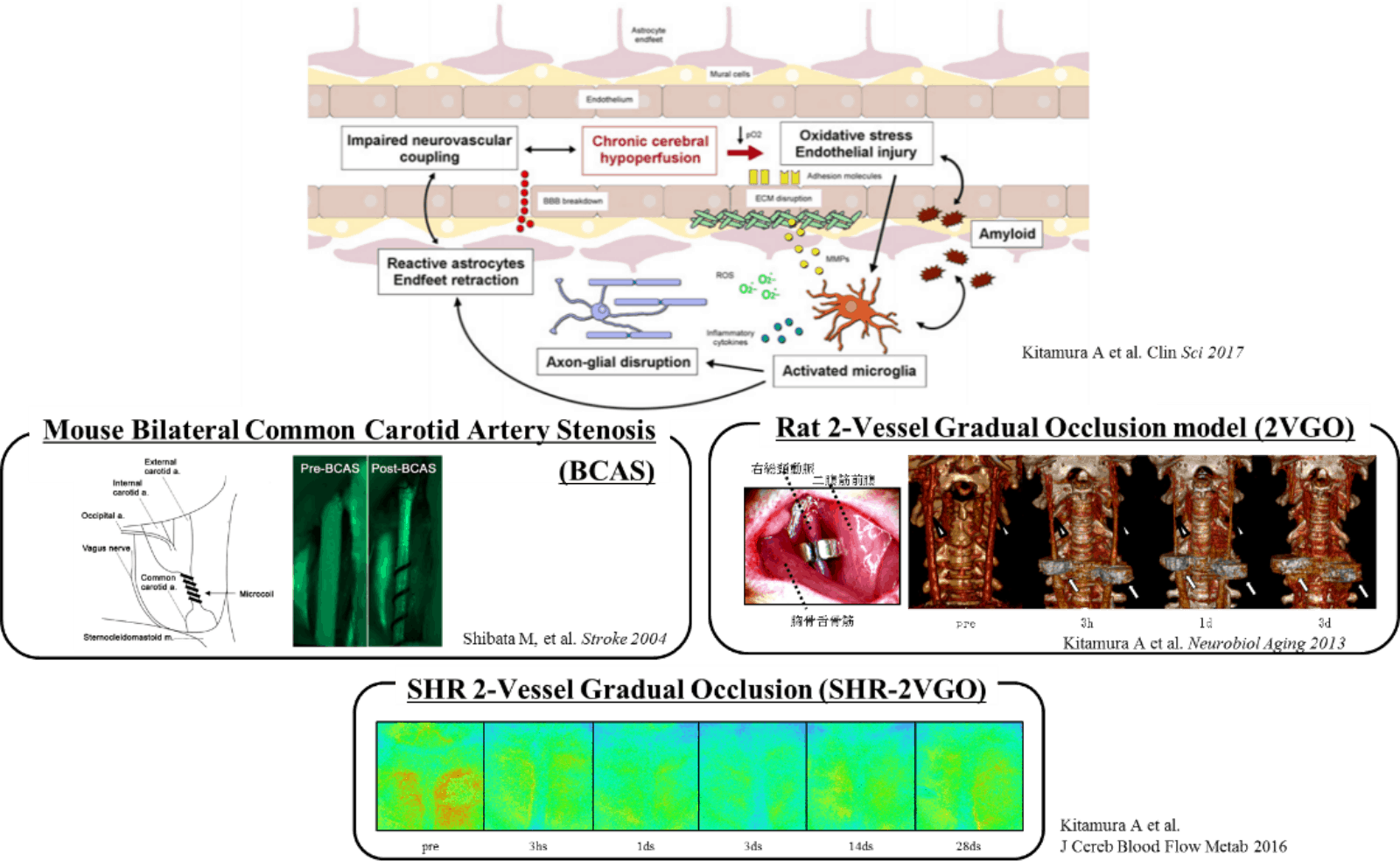
超高齢化を迎えた我が国において脳卒中患者は増加の一途をたどっています。脳卒中は血管閉塞による失語や麻痺などの機能障害と、慢性的な末梢循環不全や穿通枝系の多発梗塞による認知機能障害が2大治療標的といえますが、tPAや血管内治療といった超急性期脳梗塞の治療介入と、内服による二次予防や血行再建によって脳梗塞診療の質はここ数年で劇的に改善しています。一方、急性期脳梗塞にもBranch atheromatous disease (BAD)のような進行性で後遺症を残す病型が存在し、予後予測因子や治療法については未だ研究途上の分野です。小川はBADの機能予後予測因子を解析し有望な候補を見出しています。慢性低灌流による認知機能障害は血管性認知症と言われ、認知症の二大原因の一つです。北村はこれまでに世界で初めて頸動脈を慢性的に狭窄させるBCAS(Bilateral Common Carotid Artery Stenosis)という新たな手法を用いて、慢性低灌流による血管性認知症のラットモデルの確立に世界で初めて成功しました(9)。脳小血管は虚血のみならず、免疫学的な機能維持にも関わっており、重要な治療標的です。近年、虚血脳の修復にはエネルギー代謝効率が重要であることが明らかとなり、栄養バランスの調整により病態修飾が可能となる可能性が注目されています。我々はこうした知見に基づき、難治性脳梗塞の新たな病態解明と治療法の開発に向けて、研究を進めています。
関連業績
- Takashima N, Arima H, Kita Y, Fujii T, Tanaka-Mizuno S, Shitara S, Kitamura A, Sugimoto Y, Urushitani M, Miura K, Nozaki K. Long-Term Survival after Stroke in 1.4 Million Japanese Population: Shiga Stroke and Heart Attack Registry. J Stroke. 2020 22(3):336-344. doi: 10.5853/jos.2020.00325.
- Manso Y, Holland PR, Kitamura A, Szymkowiak S, Duncombe J, Hennessy E, Searcy JL, Marangoni M, Randall AD, Brown JT, McColl BW, Horsburgh K. Minocycline reduces microgliosis and improves subcortical white matter function in a model of cerebral vascular disease. Glia. 66(1):34-46, 2018
- Kitamura A, Duncombe J, Hase Y, Ihara M, Kalaria RN, Horsburgh K. Chronic cerebral hypoperfusion: a key mechanism leading to vascular cognitive impairment and dementia (VCID) Closing the translational gap between rodent models and human VCID. Clin Sci. 131(19):2451-2468, 2017
- Kitamura A, Manso Y, Duncombe J, Searcy J, Koudelka J, Binnie M, Webster S, Lennen R, Jansen M, Marshall I, Ihara M, Kalaria RN, Horsburgh K. Long-term cilostazol treatment reduces gliovascular damage and memory impairment in a mouse model of chronic cerebral hypoperfusion. Sci Rep. 27;7(1):4299, 2017
- Kitamura A, Saito S, b, Maki T, Oishi N, Ayaki T, Hattori Y, Yamamoto Y, Urushitani M, Kalariad RN, Fukuyama H, Horsburgh K, Takahashi R, Ihara M. Gradual cerebral hypoperfusion in spontaneously hypertensive rats induces slowly evolving white matter abnormalities and impairs working memory. J Cereb Blood Flow Metab, 2016, ;36(9):1592-602
神経疾患への再生治療研究
team:寺島、小橋
細胞移植は様々な神経疾患において有効性が報告されていますが、疾患による移植細胞の種類、細胞保護物質分泌性の付与などより有効な技術開発が進んでいます。我々は骨髄細胞にStem cell factor (SCF)と呼ばれる分化誘導因子を投与し、ALSモデルマウスに移植した結果、移植された細胞は、病変部位でミクログリア様の細胞へと分化し、GLT1という神経保護物質を発現することによってその治療効果を示すことを報告しました(1)。さらにミクログリアに抗炎症性サイトカインであるGM-CSFとIL-4を投与することで神経保護的ミクログリアへと形質転換され、それが脊髄損傷モデル(2)やALSモデル(3)への脊髄内投与で生存期間を優位に延長することを示しました。現在様々な疾患への有効性を検証しています。臨床応用を見据えた自己骨髄幹細胞やミクログリアによる理想的な細胞移植治療法の開発を進めています。。
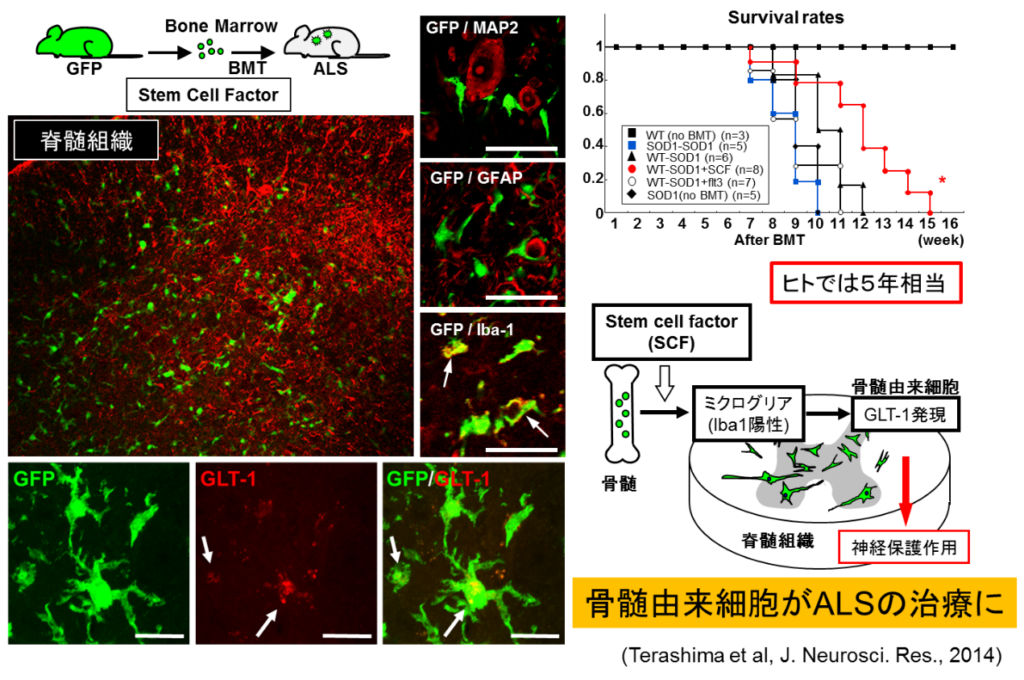
- Terashima T, Kojima H, Urabe H, Yamakawa I, Ogawa N, Kawai H, Chan L, Maegawa H. Stem Cell Factor-Activated Bone Marrow Ameliorates Amyotrophic Lateral Sclerosis by Promoting Protective Microglial Migration. J. Neurosci. Res. 92: 856, 2014.
- Terashima T, Nakae Y, Katagi M, Okano J, Suzuki Y, Kojima H. Stem cell factor induces polarization of microglia to the neuroprotective phenotype in vitro. Heliyon 2018, 4 (10), e00837.
- Kobashi S, Terashima T, Katagi M, Nakae Y, Okano J, Suzuki Y, Urushitani M, Kojima H. Transplantation of M2-deviated microglia promotes recovery of motor function after spinal cord injury in mice. Mol Ther 2020, 28: 254-265
- Terashima T, Kobashi S, Watanabe Y, Nakanishi M, Honda N, Katagi M, Ohashi N, Kojima H. Enhancing the Therapeutic Efficacy of Bone Marrow-Derived Mononuclear Cells with Growth Factor-Expressing Mesenchymal Stem Cells for ALS in Mice. iScience. 2020 Nov 4;23(11):101764.
- Ohashi N, Terashima T, Katagi M, Nakae Y, Okano J, Suzuki Y, Kojima H. GLT1 gene delivery based on bone marrow-derived cells ameliorates motor function and survival in a mouse model of ALS. Sci Reports 2021, 11: 12803, 2021.
- Kobashi S, Terashima T, Katagi M, Urushitani M, Kojima H. Bone marrow-derived inducible microglia-like cells ameliorate motor function and survival in a mouse model of amyotrophic lateral sclerosis. Cytotherapy. 2022, Apr 4:S1465-3249(22)00047-0. doi: 10.1016/j.jcyt.2022.02.001.


